研究内容
1.雄生殖細胞培養系の確立
1-1. 精原細胞‐精子培養系
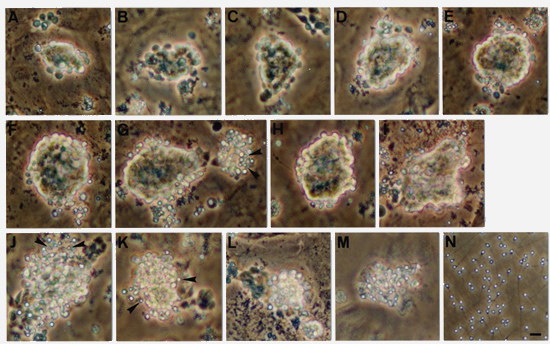
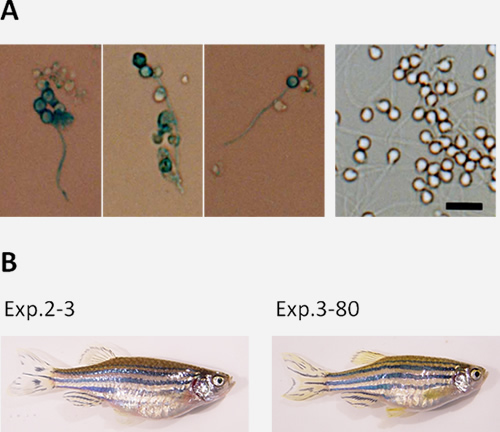
ゼブラフィッシュにおける細胞培養系による遺伝子改変技術を目標に、精原細胞から機能的精子までの培養系を確立しました。この培養系では、ゼブラフィッシュのがん化した精巣のセルトリ細胞株をフィーダーとして、精原細胞を培養します。精原細胞は塊状でフィーダーに接着し、増殖の後、精子まで分化することがわかりました(図1)。この精子を集め人工授精させたところ、正常発生する受精卵を得ることができました。以上の結果は、解離した精原細胞から減数分裂を経て機能的精子までin vitroで分化できたことを意味します。
1-2. 精原幹細胞培養系
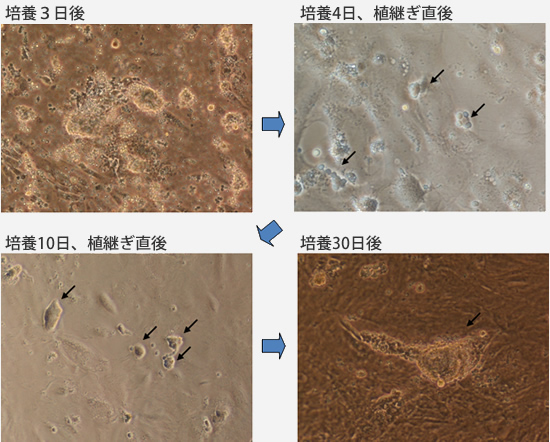
精子形成は、成体においても存在する精巣内の生殖系幹細胞(精原幹細胞)によって維持されています。この細胞を用いた遺伝子改変技術の確立を目的に、ゼブラフィッシュの精原幹細胞培養系を確立しました。上記の精原細胞-精子培養系をベースにフナ血清や種々の増殖因子の条件を振ることで、約1ヶ月にわたり精原幹細胞を維持することができる培養系を確立しました(図2)。この長さは精原幹細胞から精子まで分化する期間よりも長いものです。
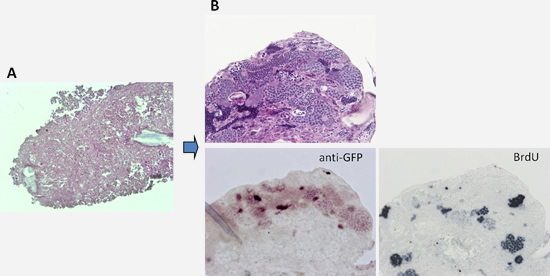
さらに私たちは、精原幹細胞の機能的アッセイ法を確立しました。精巣を解離した後、精巣細胞を再凝集して皮下移植すると、精巣の構造が再構築し精子形成が回復することがわかりました(図3)。この再凝集精巣細胞塊に標識した精原幹細胞を混ぜるとその精原幹細胞は自己再生するとともに受精可能な精子へと分化しました。培養した精原幹細胞も同様に自己再生と正常な精子への分化が認められ、次世代を作出することにも成功しました。
2.ウイルスベクターによる精原細胞への遺伝子導入
ウイルスベクターは物理的あるいは化学的方法に比べて、標的細胞にダメージを与えることが少なく、かつ効率よく遺伝子導入できる方法です。レトロウイルスはRNAをゲノムとするウイルスで、宿主内でそのゲノムは逆転写され、染色体へ挿入されます。したがって、染色体への遺伝子導入に適したウイルスベクターです。VSV-Gエンベロップを持つレトロウイルスがゼブラフィッシュ細胞に効率よく感染することが知られていたため、このウイルスを用いて精原細胞への感染を行いました。感染後、上記の精原細胞‐精子培養系で培養することで、遺伝子導入した精子を作製することに成功しました(図4)。さらに、その受精個体にも導入遺伝子が伝わることも確認できました。改変した精子の遺伝情報がそのまま受精個体の全ての細胞に伝えられるため、従来よりも一世代早く遺伝子改変動物を作出できることを意味します。
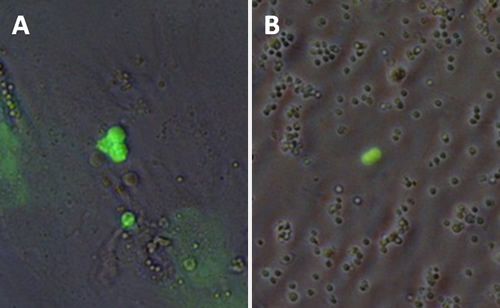
一方、アデノウイルスは2本鎖DNAをゲノムとするウイルスで、感染後そのDNAは染色体に挿入されることはほとんどありません。したがって、一過的な発現や相同組換えを目的とした遺伝子導入に向きます。私たちはヒトアデノウイルスがゼブラフィッシュ培養細胞、さらに精原細胞にも感染することを確認しました(図5)。こうしたウイルスベクターを用いてゼブラフィッシュ精原細胞への効率的な遺伝子導入法の研究を進めています。
3.近交系の樹立
近交系は、近親交配を繰り返した結果、ゲノムのほとんどがホモ接合になり、かつ個体間の多様性が失われた集団です。このように均一な遺伝的背景を持つ近交系は、生命科学の基礎研究だけではなく、医学や農学、水産学といった応用研究を進める上でも、強力な解析ツールとなります。また、人為的な相同組換えを行う対象としても適した材料です。しかし残念ながら、これまでゼブラフィッシュでは近交系が確立されていませんでした。これは、何年もかけて継代をし続けるという地道な努力を要するのに加えて、近交虚弱が現れるためだと思われます。私たちは5年以上をかけ、ゼブラフィッシュで兄妹交配を20代以上繰り返して、近交系(IM系統)の確立に成功しました。現在、この系統を利用した量的形質の統計遺伝学的解析を進めると共に、化学変異原による変異導入系の検討など、樹立した系統を有効に利用するための基盤作りにも着手しています。
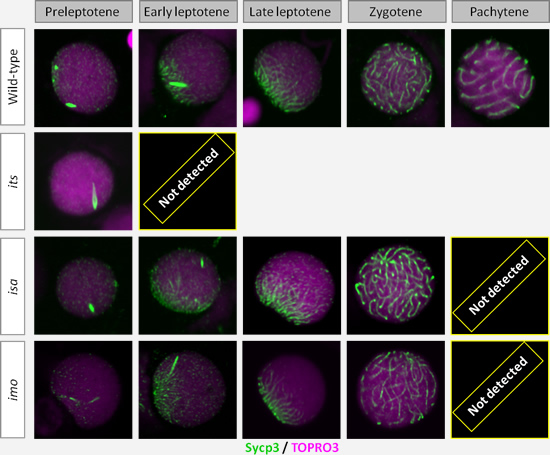
4.精子形成突然変異体を用いた精子形成調節因子の解明
精子形成は、精原幹細胞の自己再生、精原細胞への分化と体細胞分裂による増幅、精母細胞における減数分裂、さらに精子への変態過程と複雑なプロセスをたどります。これらのプロセスにかかわる因子を解析するのに、精子形成が異常となる突然変異体は有用な材料です。しかし、精子形成異常突然変異体は成体で表現型が現われ、多くの場合不稔となるため、変異体の同定や継代維持は簡単ではありません。ゼブラフィッシュは小型で多産であることから、このような精子形成変異体に対しても大規模なアプローチが十分に可能です。私たちはKellee Siegfried博士(当時Max Planck Institute, 現Harvard University)と共同でN-ethyl-N-nitrosourea(ENU)による精子形成突然変異体の単離を進め、手はじめに3つの減数分裂異常突然変異体を同定しました。そのうちの1つは、第一減数分裂のレプトテン期より前でその進行が止まってしまうユニークなものでした(図6)。現在、これらの変異体の原因遺伝子のポジショナルクローニング、培養系等による原因遺伝子の機能解析、さらに新たな精子形成異常突然変異体の同定を進めています。